|
Из уравнений  и и  следует, что следует, что
|
 |
(2.5.1) |
Учитывая, что n = N/V и N/NА = m/ = = 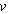 , получим , получим
|
 |
(2.5.2) |
где введена постоянная R=kNA=8,31Дж/моль*К, которую называют универсальной газовой постоянной. Физический смысл ее установим из уравнения (2.5.2):
|
 |
(2.5.3) |
которое называют уравнением Менделеева – Клапейрона. Для этого запишем уравнение (2.5.3) для двух состояний изобарического процесса:
|
PV1 = 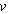 RT1 RT1 |
|
|
PV2 = 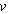 RT2 RT2 |
|
Откуда находим
|
 |
(2.5.4) |
Обозначая V2 – V1= V, T2 – T1= V, T2 – T1= T и учитывая, что работа при изобарическом процессе T и учитывая, что работа при изобарическом процессе
А = Р V, из (2.5.4) найдем R. V, из (2.5.4) найдем R.
|
 |
(2.5.5) |
т. е. постоянная R численно равна работе при изобарическом нагревании на один Кельвин ( Т = 1К) одного моля ( Т = 1К) одного моля (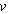 = 1 моль) идеального газа. Так как k = R/NA, то постоянная Больцмана имеет тот же смысл, что и R, только рассчитанная на одну молекулу. = 1 моль) идеального газа. Так как k = R/NA, то постоянная Больцмана имеет тот же смысл, что и R, только рассчитанная на одну молекулу.
| 
