|
Для вычисления количества теплоты, получаемой или отдаваемой системой при переходе из одного состояния в другое, используется понятие теплоемкости. Это одна из важнейших характеристик вещества. Различают молярную и удельную теплоемкости.
Молярной теплоемкостью называют количество тепла, которое необходимо сообщить одному молю, вещества, чтобы повысить его температуру на 1К:
|
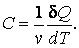 |
(4.4.1) |
Удельной теплоемкостью называют количество тепла, которое нужно передать 1 кг вещества, чтобы повысить его температуру на 1К:
|
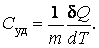 |
(4.4.2) |
В последних формулах 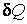 – элементарное количество тепла, переданное веществу, – элементарное количество тепла, переданное веществу,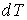 – изменение его температуры, вызванное этим теплом, – изменение его температуры, вызванное этим теплом,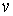 и и 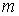 – число молей и масса вещества соответственно. – число молей и масса вещества соответственно.
Из формул (4.4.1–4.4.2) нетрудно получить связь между молярной и удельной теплоемкостями:
|
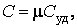 |
(4.4.3) |
где 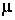 – молярная масса. В дальнейшем, в основном, будем использовать молярную теплоемкость, которую будем называть просто теплоемкостью. – молярная масса. В дальнейшем, в основном, будем использовать молярную теплоемкость, которую будем называть просто теплоемкостью.
Элементарное количество теплоты находится из выражения (4.4.1)
|
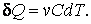 |
(4.4.4) |
Количество теплоты, получаемое системой при нагревании от температуры 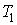 до температуры до температуры 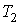 , ,
|
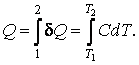 |
(4.4.5) |
Из опыта известно, что теплоемкость в общем случае зависит от температуры. Поэтому часто при вычислении количества тепла используют понятие средней теплоемкости < C >. При этом количество тепла
|
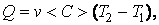 |
(4.4.6) |
где величину < c > находят, используя теорему о среднем из математического анализа:
|
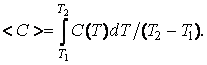 |
(4.4.7) |
Если же теплоемкость постоянна в интервале температур 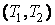 , то из выражения (2.5.5) , то из выражения (2.5.5)
|
 |
(4.4.8) |
Теплоемкость, как собственное физическое свойство вещества, зависит от его природы (химического состава). Для заданного же вещества теплоемкость существенным образом зависит от термодинамического процесса, в результате которого происходит передача тепла веществу и переход его из состояния с одной температурой в состояние с другой температурой, т. е. теплоемкость есть функция процесса. Например, при изотермическом процессе система получает тепло  а температура все время сохраняется постоянной, т. е. а температура все время сохраняется постоянной, т. е. 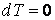 , следовательно, на основании выражения (4.4.1) имеем бесконечное значение теплоемкости для изотермического процесса , следовательно, на основании выражения (4.4.1) имеем бесконечное значение теплоемкости для изотермического процесса 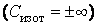 . При адиабатическом процессе система не получает и не отдает тепла . При адиабатическом процессе система не получает и не отдает тепла 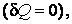 хотя его температура изменяется хотя его температура изменяется 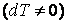 , поэтому теплоемкость любых веществ при адиабатическом процессе равна нулю , поэтому теплоемкость любых веществ при адиабатическом процессе равна нулю 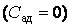 . .
Как мы знаем, внутренняя энергия веществ, не подвергнутых действию внешних полей, является функцией двух переменных 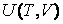 : зависимость от температуры учитывает суммарную кинетическую энергию молекул, а от объема – суммарную потенциальную энергию их взаимодействия. : зависимость от температуры учитывает суммарную кинетическую энергию молекул, а от объема – суммарную потенциальную энергию их взаимодействия.
|
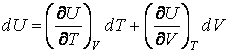 |
(4.4.9) |
|
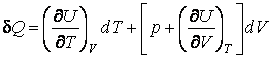 |
(4.4.9) |
|
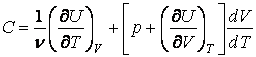 |
(4.4.10) |
Откуда находим теплоемкости при постоянном объеме и постоянном
давлении
|
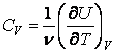 |
(4.4.11) |
|
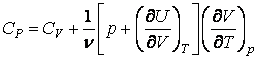 |
(4.4.12) |
Для идеального газа
|
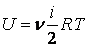 |
(4.4.13) |
|
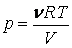 |
(4.4.14) |
|
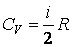 |
(4.4.15) |
|
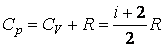 |
(4.4.16) |
Таким образом, для идеального газа теплоемкость при постоянном давлении больше теплоемкости при постоянном объеме на величину R, которая численно равна работе при изобарическом нагревании 1 моля идеального газа на 1К. Для отношения теплоемкостей получим
|
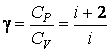 |
(4.4.17) |
В заключение этого параграфа отметим, что теплоемкость является положительной величиной 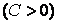 , если при получении тепла , если при получении тепла 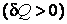 система разогревается система разогревается 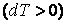 и, наоборот, если система, отдавая тепло и, наоборот, если система, отдавая тепло 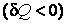 , охлаждается , охлаждается 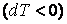 . Однако теплоемкость может быть и отрицательной . Это, как видно из формулы (4.4.1), наблюдается в двух случаях: . Однако теплоемкость может быть и отрицательной . Это, как видно из формулы (4.4.1), наблюдается в двух случаях:
1) при получении тепла система охлаждается ,
2) при отдаче тепла система разогревается .
Оба случая легко объясняются при помощи первого закона термодинамики , записанного в следующем виде:
|
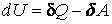 |
(4.4.18) |
В первом случае газ производит работу расширения 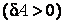 в количестве большем, чем количество теплоты в количестве большем, чем количество теплоты 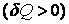 , которое подводится к газу в процессе расширения , которое подводится к газу в процессе расширения 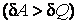 . В этом случае на производство работы помимо тепла, подведенного к газу, расходуется и некоторое количество его внутренней энергии. Хотя к газу и подводится тепло, но оно целиком превращается в работу, а убыль внутренней энергии . В этом случае на производство работы помимо тепла, подведенного к газу, расходуется и некоторое количество его внутренней энергии. Хотя к газу и подводится тепло, но оно целиком превращается в работу, а убыль внутренней энергии 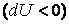 газа ведет к снижению температуры. газа ведет к снижению температуры.
Во втором случае работа, производимая над газом при его сжатии 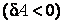 , оказывается по абсолютной величине большей, чем количество отдаваемого им тепла . С учетом знаков количества теплоты , оказывается по абсолютной величине большей, чем количество отдаваемого им тепла . С учетом знаков количества теплоты 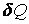 и работы и работы 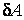 равенство (4.4.19) принимает вид: равенство (4.4.19) принимает вид:
|
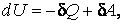 |
(4.4.19) |
Внутренняя энергия системы увеличивается , а значит, ее температура растет, несмотря на то, что газ отдает теплоту. Подобный процесс происходит в некоторых звездах: гравитационные силы при сжатии звезды совершают работу большую, чем излучаемое ей тепло, поэтому звезда разогревается, несмотря на то, что она излучает теплоту.
Наконец, обратим внимание на размерность теплоемкости. В системе СИ ее размерностью, как видно из формулы, является 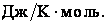
| 
