|
Пусть внутренняя энергия системы изменилась за счет взаимодействия с внешней средой на величину dU. По закону сохранения и превращения энергии таким же по абсолютной величине должно быть изменение энергии тех тел окружающей среды, с которыми провзаимодействовала система. Весь опыт физики учит, что обмен энергией между двумя любыми материальными объектами может происходить только в двух формах: в форме работы и в форме теплоты. Передача энергии в форме работы предполагает не только работу обычных сил механической природы, но электрических, магнитных сил, сил поверхностного натяжения и др. Элементарную работу произвольных сил в общем случае можно представить в виде
|
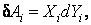 |
(4.3.1) |
где 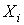 – внешняя обобщенная сила, – внешняя обобщенная сила, 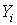 – обобщенная координата (внешний параметр, изменение которого обусловливает совершение работы). Приведем примеры. – обобщенная координата (внешний параметр, изменение которого обусловливает совершение работы). Приведем примеры.
При механическом перемещении элементарная работа
|
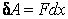 |
(4.3.2) |
где F – внешняя сила, под действием которой тело передвинулось на dx в направлении ее действия.
При вращательном движении
|
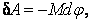 |
(4.3.3) |
где M – момент внешних сил, поворачивающих тело на угол  . Работа перемещения электрического заряда в электрическом поле . Работа перемещения электрического заряда в электрическом поле
|
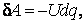 |
(4.3.4) |
где U – разность потенциалов, а q – заряд. Работа сил поверхностного натяжения
|
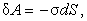 |
(4.3.5) |
где 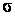 – коэффициент поверхностного натяжения, – коэффициент поверхностного натяжения, 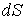 – увеличение поверхности жидкости. – увеличение поверхности жидкости.
Элементарная работа, необходимая для увеличения индукции на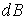 в единице объема магнетика, в единице объема магнетика,
|
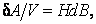 |
(4.3.6) |
где H – напряженность поля внутри магнетика.
Работа расширения вещества, совершаемая против сил равномерно распределенного внешнего давления pc окружающей среды
|
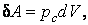 |
(4.3.7) |
где 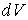 – элементарное расширение объема вещества. Число примеров можно увеличить. – элементарное расширение объема вещества. Число примеров можно увеличить.
Полная работа, которой обменивается рассматриваемая система с окружающими телами,
|
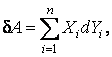 |
(4.3.8) |
где n – число разнородных воздействий (механических, электрических, магнитных и т. д.) на тело. Элементарную работу, совершаемую систе-мой над внешними телами, условились считать положительной  ; если работа совершается над системой, то ей приписывается отрицательный знак ; если работа совершается над системой, то ей приписывается отрицательный знак 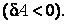
Важно подчеркнуть, что работа – это способ обмена энергией между системой и окружающей средой. Если такового обмена нет, то ни у рассматриваемой системы, ни у окружающей среды нет определенного количества работы, т. е. работа не является функцией состояния.
Второй способ изменения внутренней энергии системы не сопровождается макроскопической (видимой) работой, т. е. при этом способе внешние тела не перемещаются или не изменяются действующие на систему внешние поля. Этот способ изменения внутренней энергии системы называют теплообменом (теплопередачей) и заключается он в том, что рассматриваемая система приводится в тепловой контакт с внешней средой, имеющей температуру, отличную от температуры самой системы. Передача энергии в процессе теплообмена происходит на микроскопическом уровне в результате столкновения молекул на поверхности раздела тел: молекулы тела с большей температурой имеют большую среднюю кинетическую энергию и передают ее молекулам другого тела, имеющего меньшую температуру.
Количество энергии, которым обменивается система и окружающая среда в процессе теплообмена, называют количеством теплоты. Элементарное количество теплоты, полученное системой, принято считать величиной положительной 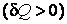 , отданное – отрицательной , отданное – отрицательной 
Количество теплоты проявляется только в процессе обмена энергией системы и окружающей среды. Поэтому бессмысленно говорить, что у тела есть определенное количество теплоты. У тела может быть только определенное количество внутренней энергии. Поэтому внутренняя энергия – функция состояния, а теплота, как и работа, не является функцией состояния.
Все три введенные величины – внутренняя энергия, работа и теплота входят в уравнение первого закона термодинамики. Согласно этому закону, количество теплоты 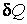 , полученное системой, расходуется на изменение внутренней энергии , полученное системой, расходуется на изменение внутренней энергии 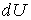 и на совершение системой работы и на совершение системой работы 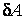 : :
|
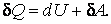 |
(4.3.9) |
Если система частиц изолирована, т. е. не обменивается энергией с окружающей средой ни в форме работы  ни в форме теплоты ни в форме теплоты 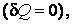 то то 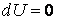 и внутренняя энергия сохраняется (U = const). Таким образом, первый закон термодинамики – это приложение более общего закона сохранения энергии к термодинамическим процессам, при которых происходит превращение работы, понимаемой в обобщенном смысле (4.3.8), в теплоту и теплоты в работу. и внутренняя энергия сохраняется (U = const). Таким образом, первый закон термодинамики – это приложение более общего закона сохранения энергии к термодинамическим процессам, при которых происходит превращение работы, понимаемой в обобщенном смысле (4.3.8), в теплоту и теплоты в работу.
В частных случаях, например, при изменении объема системы (в этом случае 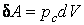 ) первый закон термодинамики имеет вид: ) первый закон термодинамики имеет вид:
|
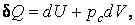 |
(4.3.10) |
при изменении электрической индукции системы:
|
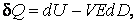 |
(4.3.11) |
при изменении магнитной индукции магнетика:
|
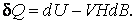 |
(4.3.12) |
В последних двух выражениях (4.3.11–4.3.12) E и H – электрическое и магнитное поля, наложенные на систему, имеющую объем V, а знак минус учитывает, что внешние поля совершают работу над системой частиц.
Первый закон термодинамики (4.3.9) записан в дифференциальной форме, т.е. для бесконечно малых величин. Чтобы представить его в интегральной форме, проинтегрируем левую и правую части (4.3.9) от некоторого состояния 1 до состояния 2. В результате будем иметь
|
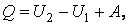 |
(4.3.13) |
где 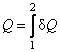 – количество теплоты, полученное системой при переходе из состояния 1 в состояние 2, – количество теплоты, полученное системой при переходе из состояния 1 в состояние 2, 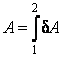 – работа, совершенная системой над внешними телами при этом переходе, и, наконец, – работа, совершенная системой над внешними телами при этом переходе, и, наконец, 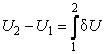 – изме-нение внутренней энергии при том же переходе. – изме-нение внутренней энергии при том же переходе.
Таким образом, согласно первому закону термодинамики, тепловое движение в системе определяется изменением внутренней энергии системы и величиной совершаемой системой работы. Следовательно, в термодинамической системе энергия не исчезает и не создается, а лишь изменяет свои формы.
| 
