|
Из уравнения состояния идеального газа 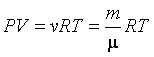 можно получить известные из опыта газовые законы. можно получить известные из опыта газовые законы.
1. Полагая в уравнении 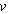 = const и Т = const, получаем = const и Т = const, получаем
Отсюда вытекает формулировка закона Бойля – Мариотта (изотермический процесс): при неизменных массе и температуре идеального газа произведение его объема на давление есть величина постоянная.
2. При изобарическом процессе P = const. Также 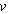 = сonst. Поэтому из уравнения состояния в этом случае = сonst. Поэтому из уравнения состояния в этом случае
|
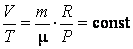 |
(2.6.2) |
т. е. при неизменных массе и давлении идеального газа отношение объема, занимаемого газом, к его температуре – величина постоянная. Это утверждение известно как закон Гей-Люссака.
3. Пусть процесс протекает при постоянном объеме V=const (по
прежнему Также 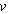 = сonst). = сonst).
|
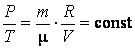 |
(2.6.3) |
т. е. при неизменных массе и объеме идеального газа отношение давления газа к его температуре есть величина постоянная. Уравнение (2.6.3), называемое уравнением изохорического процесса, выражает известный закон Шарля.
4. Из уравнения очевидно, также следует объединенный закон Мариотта – Гей- Люссака
|
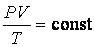 |
(2.6.3) |
т. е. произведение давления газа на его объем, деленные на абсолютную температуру, для данной массы газа есть величина постоянная.
| 
