|
Большинство химических веществ состоит из многоатомных молекул. Если рассматривать газообразное состояние вещества, то при столкновениях молекул тепловая энергия газа случайным образом расходуется на изменение кинетических энергий поступательного и вращательного движений молекул, а также на возбуждение колебаний атомов в молекуле. Естественно предположить, что указанные движения в молекуле могут происходить одновременно.
Важнейшим в теории является решение задачи нахождения закона распределения полной энергии газа по этим трем видам движения молекул.
Чтобы найти среднюю энергию молекулы, приходящуюся на все виды ее движения, сначала выясняют, каким числом степеней свободы обладает данная молекула, и далее, – какая энергия приходится в среднем на одну степень свободы.
Число степеней свободы i молекулы равно количеству независимых координат, определяющих ее положение относительно выбранной системы координат.
Если рассматривать атомы как бесструктурные точки, то одноатомные молекулы могут иметь только энергию поступательного движения. Число степеней свободы каждой такой точки iпост = 3 (три декартовы координаты x, y, z или три сферические 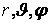 определяют положение одноатомной молекулы в пространстве). Система, состоящая из N одноатомных молекул, между которыми нет жестких связей, имеет 3N степеней свободы. определяют положение одноатомной молекулы в пространстве). Система, состоящая из N одноатомных молекул, между которыми нет жестких связей, имеет 3N степеней свободы.
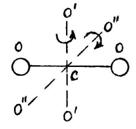
Двухатомную молекулу представим как систему, состоящую из двух материальных точек. Если расстояние r между атомами в молекуле не изменяется (атомы в молекуле не колеблются и с увеличением частоты вращения молекула не растягивается), то число степеней свободы равно пяти. В самом деле, если расстояние между атомами 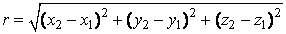 , где , где 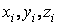 – координаты i-го атома в молекуле (i = 1, 2), фиксировано, то всего имеется пять независимых координат, шестая определяется из последнего соотношения. Положение двухатомной молекулы, состоящей из двух жестко связанных атомов, задают обычно не пятью декартовыми координатами, а тремя координатами центра С (x, y, z) масс молекулы и двумя углами – координаты i-го атома в молекуле (i = 1, 2), фиксировано, то всего имеется пять независимых координат, шестая определяется из последнего соотношения. Положение двухатомной молекулы, состоящей из двух жестко связанных атомов, задают обычно не пятью декартовыми координатами, а тремя координатами центра С (x, y, z) масс молекулы и двумя углами 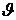 и и 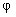 , определяющих направление в пространстве прямой, проходящей через два атома молекулы. Если , определяющих направление в пространстве прямой, проходящей через два атома молекулы. Если 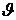 и и 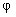 неизменны, а изменяются координаты центра масс, то это указывает на то, что молекула движется поступательно. Это дает три поступательные степени свободы (iпост = 3). Изменение же углов неизменны, а изменяются координаты центра масс, то это указывает на то, что молекула движется поступательно. Это дает три поступательные степени свободы (iпост = 3). Изменение же углов 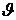 и и 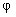 при фиксированных координатах центра масс определяет вращение молекулы вокруг двух взаимно перпендикулярных осей при фиксированных координатах центра масс определяет вращение молекулы вокруг двух взаимно перпендикулярных осей 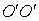 и и 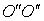 , проходящих через центр масс, и перпендикулярных оси ОО молекулы (рис. 1). , проходящих через центр масс, и перпендикулярных оси ОО молекулы (рис. 1).
 |
| рис. 1 |
Вращение молекулы вокруг оси ОО не учитывают, так как энергия этого вращения значительно меньше двух других (из-за малости моментов инерции атомов). Поэтому у двухатомной молекулы две вращательные степени свободы, т. е. 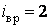 . Если расстояние между атомами в молекуле меняется, то это означает, что атомы колеблются друг относительно друга. В этом случае у двухатомной нежесткой молекулы имеется шесть степеней свободы ( . Если расстояние между атомами в молекуле меняется, то это означает, что атомы колеблются друг относительно друга. В этом случае у двухатомной нежесткой молекулы имеется шесть степеней свободы ( 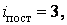 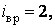 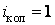 ). ).
Если число атомов в молекуле 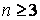 , то по динамическим свойствам их делят на линейные (типа молекул HCN, CO2 рис. 2) и нелинейные (например, молекула воды H2O). , то по динамическим свойствам их делят на линейные (типа молекул HCN, CO2 рис. 2) и нелинейные (например, молекула воды H2O).
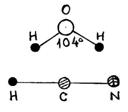 |
| рис. 2 |
В линейных молекулах, в отличие от нелинейных, атомы расположены вдоль одной прямой. Поэтому жесткая линейная молекула содержит столько же степеней свободы, сколько имеет жесткая двухатомная, т. е. пять. Нелинейная жесткая молекула, очевидно, имеет, как и твердое тело, шесть степеней свободы.
Нелинейные молекулы имеют 3n – 6 колебательных степеней свободы, так как из общего числа 3n степеней свободы три относятся к поступательному и три к вращательному движению. У линейной молекулы существуют две степени свободы вращательного и три поступательного движения, поэтому для нее число колебательных степеней свободы 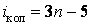 . Можно доказать, что произвольное колебательное движение атомов в нелинейной молекуле всегда можно представить в виде суммы 3n – 6 простейших так называемых нормальных колебаний (и 3n – 5 для линейной молекулы). Нормальное колебание – гармоническое, при котором все ядра атомов в молекуле колеблются с одной и той же частотой и одинаковой фазой, т. е. одновременно проходят через положение равновесия. На рис. 3 показаны нормальные колебания молекулы CO2 . Стрелки показывают направление скорости при колебаниях атомов и приблизительно величину амплитуды (длина стрелки). . Можно доказать, что произвольное колебательное движение атомов в нелинейной молекуле всегда можно представить в виде суммы 3n – 6 простейших так называемых нормальных колебаний (и 3n – 5 для линейной молекулы). Нормальное колебание – гармоническое, при котором все ядра атомов в молекуле колеблются с одной и той же частотой и одинаковой фазой, т. е. одновременно проходят через положение равновесия. На рис. 3 показаны нормальные колебания молекулы CO2 . Стрелки показывают направление скорости при колебаниях атомов и приблизительно величину амплитуды (длина стрелки).
Два нижних колебания вырождены, т. е. имеют одинаковую частоту.
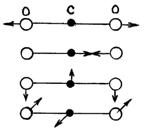 |
| рис. 3 |
Кинетическая энергия одноатомной молекулы, имеющей три степени свободы, равна
|
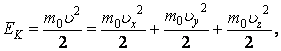 |
(2.16.1) |
т. е. содержит столько слагаемых, сколько у нее степеней свободы. Чтобы определить, какая в среднем энергия приходится на дну степень свободы, усредним обе части выражения (2.16.1).
|
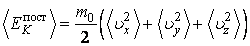 |
(2.16.2) |
Из формул 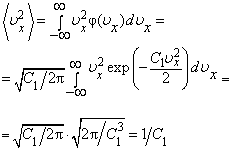 и и 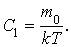 следует, что следует, что
|
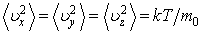 |
(2.16.3) |
Умножая обе части равенств (2.16.3) на 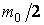 , получим , получим
|
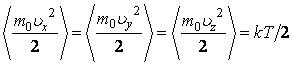 |
(2.16.4) |
Таким образом, на каждую степень свободы одноатомной молекулы приходится энергия, равная 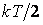 . Подстановка (2.16.4) в (2.16.2) дает среднюю кинетическую энергию поступательного движения одноатомной молекулы: . Подстановка (2.16.4) в (2.16.2) дает среднюю кинетическую энергию поступательного движения одноатомной молекулы:
|
 |
(2.16.5) |
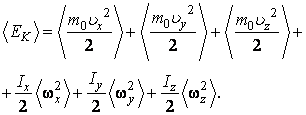
Жесткая нелинейная молекула имеет три поступательные и три вращательные степени свободы, поэтому ее кинетическая энергия содержит шесть слагаемых.
|
 |
(2.16.6) |
где 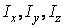 – моменты инерции молекулы относительно трех декартовых осей координат, проходящих через центр инерции молекулы; – моменты инерции молекулы относительно трех декартовых осей координат, проходящих через центр инерции молекулы; 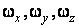 – проекции угловой скорости вращения молекулы на те же оси координат. Аналогичное выражение можно записать для средних величин: – проекции угловой скорости вращения молекулы на те же оси координат. Аналогичное выражение можно записать для средних величин:
Аналогичное выражение можно записать для средних величин:
|
 |
(2.16.7) |
Установим, какая в среднем энергия приходится на одну вращательную степень свободы. Для этого, как видно из последнего выражения, необходимо вычислить средние квадраты угловой скорости
|
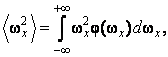 |
(2.16.8) |
где 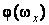 – функция распределения молекул по проекции угловой скорости. Функция – функция распределения молекул по проекции угловой скорости. Функция 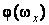 должна иметь такой же вид, как распределение Максвелла должна иметь такой же вид, как распределение Максвелла 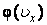 , ибо для нахождения , ибо для нахождения 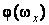 полностью применимы такие же рассуждения, какие были сделаны при выводе полностью применимы такие же рассуждения, какие были сделаны при выводе 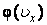 . При этом нужно учесть, что при вращательном движении роль массы выполняет момент инерции, а поступательная скорость . При этом нужно учесть, что при вращательном движении роль массы выполняет момент инерции, а поступательная скорость 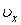 заменяется угловой заменяется угловой 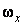 . Поэтому . Поэтому
|
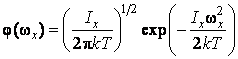 |
(2.16.9) |
Подставляя (2.16.9) в (2.16.8) и выполняя интегрирование, находим
|
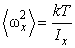 |
(2.16.10) |
Аналогично получаем
|
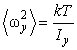 |
(2.16.11) |
Из выражений (2.16.9) и (2.16.10) находим
|
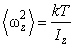 |
(2.16.12) |
Таким образом, на каждую вращательную степень свободы приходится такая же энергия 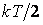 , как и на поступательную. При этом кинетическая энергия, которой обладает жесткая нелинейная молекула, согласно выражения (2.16.7), равна , как и на поступательную. При этом кинетическая энергия, которой обладает жесткая нелинейная молекула, согласно выражения (2.16.7), равна
|
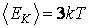 |
(2.16.13) |
Если в многоатомной молекуле возбуждены колебания атомов (это наблюдается при температурах значительно больших комнатных), то на каждое нормальное колебание молекулы приходится энергия в два раза большая, чем на поступательную или вращательную степень свободы. Это связано с тем, что при гармонических колебаниях, как известно из механики, среднее значение кинетической энергии равно среднему значению потенциальной энергии; если на одну степень свободы поступательного движения приходится кинетическая энергия 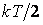 , то такая же энергия , то такая же энергия 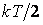 падает и на потенциальную энергию. Поэтому тепловая энергия, приходящаяся на одну колебательную степень свободы молекулы, равна падает и на потенциальную энергию. Поэтому тепловая энергия, приходящаяся на одну колебательную степень свободы молекулы, равна
|
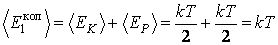 |
(2.16.14) |
Из сказанного в этом параграфе, можно высказать утверждение, известное как закон равнораспределения тепловой энергии по степеням свободы: если система молекул находится в равновесном газообразном состоянии, то средняя кинетическая энергия, приходящаяся на каждую поступательную, вращательную и колебательную степени свободы его молекул, равна 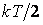 , средняя потенциальная энергия, приходящаяся на каждое нормальное гармоническое колебание атомов в молекуле, также равна , средняя потенциальная энергия, приходящаяся на каждое нормальное гармоническое колебание атомов в молекуле, также равна 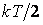 . .
Закон равнораспределения, строгое доказательство которого дается в статистической термодинамике, ограничен областью применимости классического приближения. Как показывается в квантовой статистике, он справедлив для поступательного движения молекул, находящихся при температуре Т, если выполняется неравенство 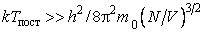 , где h,k – постоянные Планка и Больцмана, m0 – масса молекулы, N и V – число молекул и объем газа соответственно, для вращательного – , где h,k – постоянные Планка и Больцмана, m0 – масса молекулы, N и V – число молекул и объем газа соответственно, для вращательного – 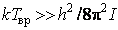 , где I – момент инерции молекулы, и, наконец, для колебательного движения – , где I – момент инерции молекулы, и, наконец, для колебательного движения – 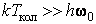 , где , где 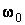 - частота нормального колебания. Значение температуры, при которой выполняются указанные неравенства, отличаются друг от друга порядком величин. Так, например, для молекул кислорода и азота - частота нормального колебания. Значение температуры, при которой выполняются указанные неравенства, отличаются друг от друга порядком величин. Так, например, для молекул кислорода и азота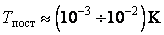 , , 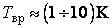 , , 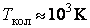 и поэтому при комнатной температуре и поэтому при комнатной температуре 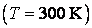 возбуждены поступательные и вращательные степени свободы и, таким образом, подчиняются закону равнораспределения, тогда как колебательные заморожены и практически не дают никакого вклада в термодинамические характеристики газа. возбуждены поступательные и вращательные степени свободы и, таким образом, подчиняются закону равнораспределения, тогда как колебательные заморожены и практически не дают никакого вклада в термодинамические характеристики газа.
В сфере своей применимости закон равнораспределения позволяет очень просто по известному числу степеней свободы i молекул находить их полную среднюю энергию теплового движения E:
|
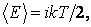 |
(2.16.15) |
где
|
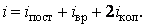 |
(2.16.16) |
В последнем соотношении число колебательных степеней свободы удвоено, так как, с учетом вышеизложенного, на каждую колебательную степень свободы приходится энергия
В заключение отметим, что закон равнораспределения применим к идеальному газу. Если же газ находится при больших давлениях, то при вычислении полной энергии газа E необходимо учитывать энергию взаимодействия молекул между собой.
|

